结核疫苗研究进展和未来展望
发布时间:2009年09月04日 作者:张昌盛
贾 浩1 张昌盛2 徐广贤1 张 艳1 王玉炯1*1
宁夏大学生命科学学院,宁夏银川市 7500212 北京自然博物馆, 北京 100050
摘 要: 结核分枝杆菌引起的结核病是一种人畜共患的传染病。近几年来随着结核分枝杆菌多耐药性菌株(MDR)的增多和艾滋病的不断流行,使结核病死灰复燃,因此如何能够有效地控制和预防结核病的发生就显得极其重要。目前卡介苗(BCG)仍然是人们普遍使用的疫苗,但其免疫预防效果不甚理想。所以研究新型的疫苗迫在眉睫,本文将对结核疫苗研究最新进展和未来展望进行综述。
关键词:卡介苗(BCG)、结核病、亚单位疫苗、重组卡介苗、基因缺失疫苗
TB Vaccine Research Progress And Prospects
Jia Hao1 Zhang Changsheng2 Xu Guangxian1, Zhang Yan1 Wang Yujiong1*1
College of Life Science Ningxia University, Yinchuan 750021, China2 Beijing Natural History Museum, Beijing 100050
Abstract Arising from the combination of Mycobacterium tuberculosis is a zoonotic infectious diseases. In recent years with Mycobacterium tuberculosis strains of multiple drug resistant (MDR) and the increase in the AIDS epidemic, how to effectively control and prevention of the occurrence of TB it is extremely important. At present Bacillus Calmette-Guerin (BCG) is still widespread use of the vaccine, but their immune preventive effect not ideal. Therefore, researching of the new vaccine is necessitous to carry out . In this paper, research is currently being conducted of the vaccine, and look into the TB vaccine’s future.
Keywords: BCG, Tuberculosis, Subunit vaccines, Recombinant BCG, Gene deletion vaccines
1.引 言结核病是由结核分枝杆菌感染引起的慢性传染病,近几年来结核病患者数量不断增加。全球现有1/3(约20亿)的人群感染了结核病,现有结核病人约2000万,每年新发生约900万病人,每年死亡人数高达300万。据2008年3月24日世界卫生组织最新报告(World Health Prganization, 2008),2006年,有920万起新发结核病例(每10万人口139例),包括410万起痰涂片阳性(涂阳)新病例(占总数44%)和70万例艾滋病病毒阳性病例(占总数8%)。由于人口增长,与2005年的910万例相比有所增长。就绝对病例数而言,印度、中国、印度尼西亚、南非和尼日利亚排名第一至第五位(图1)。非洲区域的人均发病率最高(每10万人口363例)。中国是世界上结核疫情非常严重的国家之一,发病率排名世界第二,占全球所有结核病例的15%左右(邢玉树,2007)。导致结核病又回到“不治之症"年代的主要原因是结核分枝杆菌多耐药性菌株(MDR)的增多和艾滋病的不断流行。2006年全球新增920万结核病例中,有70万例同时感染艾滋病毒,50万例属于多耐药性结核(图2)(World Health Prganization, 2008)。现在世界上约有5000万人感染结核分枝杆菌多耐药性结核菌株(MDR),在一些地区超过10%的结核
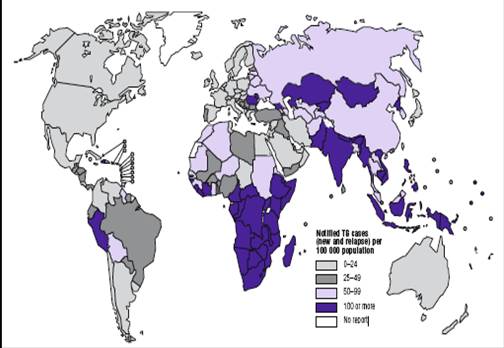
图1.世界结核杆菌病2006年流行情况示意图[1]
fig 1. Tuberculosis notification rates, by country,2006[1]
病例为多耐药性结核菌株(World Health Prganization, 2004)。而在中国新增病例的5%、所有结核病例的1/4以上,被确定为结核分枝杆菌多耐药性结核菌株(MDR),目前的两种或多种主要疗法都不能治愈该病。随着中国政府对控制该疾病关注度的提高,中国的结核病流行程度开始下降。政府在结核治疗及检查方面的投资显著提高,每年大约为3800万美元(邢玉树,2007)。另一个使全球结核病回升的原因便是HIV和结核分枝杆菌双重感染。据统计,AIDS病人结核病发病率是正常人的30倍,结核分枝杆菌感染人群的终生发病仅为10%左右,而HIV及结核分枝杆菌双重感染者年发病率为5%-8%,1/3的AIDS病人死于结核病。HIV(+)患者中感染结核分枝杆菌后可缩短HIV感染的潜伏期,加速发展为AIDS。可见HIV(+)和结核分枝杆菌两者相互影响,相互促进疾病发展。因此HIV感染是目前已知的结核病的最大危险因素之一(中华医学会,2005)。
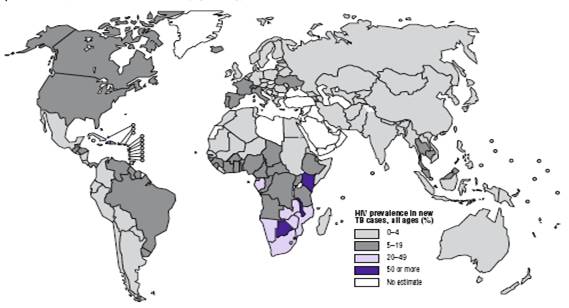
图2.2006年新发结核病中感染HIV病毒情况示意图(World Health Prganization, 2008)
fig 2.Estimated HIV prevalence in new TB cases, by country,2006 (World Health Prganization, 2008)
2 卡介苗(BGC)存在的问题迄今为止,卡介苗(BCG)仍是世界上接种最广泛的一种疫苗,于1921年首先获得批准使用,主要用于结核病高发的地区,自从1974年世界卫生组织将它列入免疫接种计划以来,大约有40亿剂的卡介苗得到接种。卡介苗(BCG)是Albert Calmette和Camille Guérin在1908年将1个牛型结核分枝杆菌强毒株在含甘油、胆汁和马铃薯的培养基中历经13年共230次传代培养,在1920年获得了1个减毒株,命名为卡介苗。目前对卡介苗的广泛使用仍在继续,其免疫效果在10-15年之后开始减退,使得其对儿童的保护作用以及对预防青少年和成年人患肺结核的有效性受到限制。而且卡介苗(BCG)也无法预防潜伏性的结核菌感染。但它仍有不可替代性,新疫苗应在BCG使用管理的基础上开发研制。但是目前我们在研制疫苗方面缺少一个标准,即对结核疫苗的评估体系,因此BCG成了评估新疫苗的“金”标准(吕华坤等,2004)。BCG是减毒活疫苗,可引起淋巴结肿大和化脓等异常反应。在接种BCG的过程中,除了会干扰纯蛋白衍生物(purified protein derivatives,PPD)诊断结核分枝杆菌感染的价值,最主要的禁忌之一就是当接种者有免疫缺陷,特别是细胞免疫缺陷时,不能进行疫苗接种。BCG可以在接种者体内存活几十年。曾有这样的病例报道:病人在童年时接种过BCG,后来得了艾滋病,于是机体表现出因疫苗而导致的结核病。而艾滋病人由于严重的免疫缺陷,也极易感染结核病,所以如果应用于免疫功能有缺陷的患者(如HIV感染者),可能会使BCG在患者体内播散而导致患者死亡。BCG在传代和减毒的过程中发生了菌株的变异,Cole等运用DNA指纹技术发现10%的BCG基因组高度可变,Behr等运用基因芯片技术发现BCG较牛结核分枝杆菌缺失RD1-RD16这16个基因区域。BCG较牛型结核分枝杆菌缺失RD1、RD2、RD8、RD14和RD16这5个区域,所有BCG株均缺乏RD1区域,进一步研究发现BCG在1908-1921年间的减毒过程中发生RD1区域缺失,在1927-1937年间在巴斯德研究所传代过程中发生RD2区域缺失,从1938年第576代传至1961年第1173代时发生RD14区域缺失,在1938-l948年间在Montreal地区发生RD8区域缺失,巴西和乌拉圭从1925年开始缺失RD16区域,造成BCG不能编码ESAT-6和CFP10等重要T细胞抗原,因此不能诱导机体产生理想的保护力(李文桂,2005)。
3 结核疫苗的研究策略从研究疫苗的总体思路来看,目前结核疫苗的研究策略主要有以下几种(Peter, 2007)。第一种策略将一些重要的抗原或者其它因子重新导入到现有的BCG株,得到一个以BCG为载体的重组BCG疫苗,或者使结核分枝杆菌的基因缺失得到基因缺失突变株从而制造出新的结核疫苗,取代我们传统用的BCG,这种方法制备的结核分枝杆菌减毒活疫苗可显著地表达多种抗原并激活各T细胞群联合免疫。作为临床试验的候选,这种疫苗肯定会比BCG更有效,更安全(Kamath et al., 2005)。第二种策略是对已接种卡介苗的儿童进行强化免疫,进而加强免疫应答并将免疫保护力延续至成人阶段。这一策略目前公认的最佳方案是应用亚单位疫苗加强免疫。亚单位疫苗组成明确,结构简单,可应用于有免疫缺陷的人群,倍受人们关注。亚单位疫苗主要是由有限数量的抗原构成,所引起的保护性免疫应答也高度集中。但其在体内滞留时间短,免疫应答的持续时间也较短,必须与佐剂联用才有效,使其应用受到限制,几种主要的候选疫苗均采用了将单抗原与多聚蛋白融合的方法,这样不仅增强了单抗原的免疫力,也易于进行规模化生产。所以佐剂的发展对强化免疫策略的实现功不可没。几年之前,只有一种佐剂适用于结核疫苗,其刺激T细胞反应的效力弱而且对人体有很大的毒性。近几年来这一情况得到了迅速改善,许多有前景的新T细胞佐剂已在结核疫苗的临床前期终末阶段及临床期使用,如AS02A、IC31、阳离子脂质体以及粘膜分泌的LTK63(表1)(Kamath, et al., 2005)。第三种策略是将重组BCG和亚单位疫苗或两种以上的疫苗结合到一起,从而解决结核疫苗免疫效果低下这一难题,虽然这个方法要求至少需要几年的时间进行第三期临床试验,这就需要做一个时间计划表来设法减少疫苗期试验,做一个成功的疫苗接种计划(Stefan, 2006)。
4 结核疫苗的研究与发展状况从疫苗结构完整性来看一般可分为:重组BCG、亚单位疫苗、DNA疫苗基因和缺失疫苗等。结核疫苗在最近的几十年里,有了长足的进展,一部分已经进入了临床第一期实验,还有一部分进入了第二期临床实验(Peter, 2007)(表1)。表1:最新的结核病临床候选疫苗Table 1: TB Vaccine Research Progress疫苗名称及种类开发阶段开发公司重组弱毒疫苗: rBCG30(Horwitz et al., 2000)第一期临床2004年完成美国加利福尼亚大学洛杉矶分校医学院/Aeras全球结核病疫苗基金会rBCG△reC:Hly(Grode, et al., 2005)第一期临床2007年计划开始德国柏林Max-Planck研究所/德国疫苗计划管理处BCG::RDI研究中,未进入临床美国柯尔,巴斯德研究所,法国,巴黎MVA-85A 第一期临床进行中,在冈比亚进行测试牛津大学基因剔除疫苗ICL研究中,未进入临床 美国亚单位疫苗: H1/IC31第一期临床进行中丹麦国立血清研究所/ Intercell公司Mtb72f/AS02A(Olsen,et al., 2004)第一期临床进行中葛兰素史克生物制品公司H1/LTK63第一期临床进行中丹麦国立血清研究所/诺华制药公司HyVac4/IC31第一期临床2007年中期计划开始丹麦国立血清研究所/Intercell公司/Aeras全球结核病疫苗基金会J774-HSP65/BMC-HSP65第一期临床进行中ImmunoBiology/Aeras全球结核病疫苗基金会DNA疫苗: Ag85B、ESAT-6、MPT-63和MPT-64的基因的组合DNA四联疫苗研究中,未进入临床中国Pro-apoptotic BCG研究中,未进入临床Nashvile VA MedicalCenter结核菌株Mt103去除phoP基因疫苗(Skeiky et al., 2006)研究中,未进入临床萨拉戈萨大学,西班牙;巴斯德研究所,法国,巴黎结核菌株mc26030疫苗第一期临床进行中美国卫生研究院(NIH)结核菌株mc26020疫苗第一期临床进行中美国卫生研究院(NIH)5 结核病疫苗的未来展望。最近几年由于结核病的死灰复燃,引起社会各界的广泛关注。随着来自公共基金如欧盟、政府卫生机构和比尔&梅林达.盖茨基金的投资的不断增加,结核疫苗的研究、开发和评估已经成为热点,并且几种疫苗已进入早期临床阶段(Peter, 2007)。当BCG的保护性捉襟见肘时,基因疫苗开始成为了科学家们关注和研究的焦点。1998年,英国的Sanger中心和法国Pasteur研究所联合完成了人肺结核分枝杆菌H37Rv全基因组序列图(徐广贤,2006),这就为更好的研究新型疫苗奠定了一定的基础。大概再过2年的时间,科学家预计在2010年将会有新的疫苗进入到第三期临床试验中,在2015年以前还会有20多种新的结核疫苗进入到第一期临床试验中。而最终目标是在2015年获得一种安全、有效而且廉价的新疫苗进行全球推广应用。新疫苗的应用可以使非洲和东南亚等结核病高发国家和地区的结核病发病率每10年减少20%,经过持之以恒的工作和持续不断的努力,到2050年则有可能在全球达到控制和逐步消灭结核病的宏伟目标[1]。
参考文献
World Health Organization. 2008. WHO REPORT 2008 Global Tuberculosis Control-Surveillance,Planning,
Financing[N].World Health OrganizationGeneva,
邢玉树. 2007中国结核病发病率位居世界第二[N].北京晨报,
2007-2-27.World Health Organization. 2004.Global Tuberculosis Control —Surveillance, Planning,
Financing [N]. World Health OrganizationGeneva
中华医学会编著, 2005. 临床诊疗指南.结核病分册[M].人民卫生出版社出版,2005-6-1
吕华坤,许卫国,王蓓. 2004, 人类结核菌疫苗研究进展[J].江苏预防医学, 15(2)
李文桂, 2005, 结核分枝杆菌热休克蛋白DNA疫苗研究进展[J].热带病与寄生虫学.
Peter Andersen, 2007. Tuberculosis vaccines - an update. Nature Reviews Microbiology,.7(5),484-487.
Kamath, A. T. et al. 2005. New live mycobacterial vaccines: the Geneva consensus on essential steps towards clinical development. Vaccine.(23: 3753-3761.
Kaufmann, S. H. 2005. Recent findings in immunology give tuberculosis vaccines a new boost. Trends .Immunol. 26: 660-667.
StefanH.E.Kaufmann. 2006. Envisioning future strategies for vaccination against tuberculosis. .NATURE REVIEWS IMMUNOLOGY,:699-703
Horwitz, M. A., Harth, G., Dillon, B. J. & Maslesa-Galic, S. 2000. Recombinant bacillus Calmette-Guérin (BCG) vaccines expressing the Mycobacterium tuberculosis 30-kDa majorsecretory protein induce greater protective immunity against tuberculosis than conventional BCG vaccines in a highly susceptible animal model. Proc[J]. Natl Acad Sci. USA 97,: 13853–13858.
Grode, L. et al. 2005. Increased vaccine efficacy against tuberculosis of recombinant Mycobacterium bovis bacille Calmette–Guérin mutants that secrete listeriolysin. J. Clin[J]. Invest. 115: 2472–2479.
Olsen, A. W., Williams, A., Okkels, L. M., Hatch, G. & Andersen, P. 2004. Protective effect of a tuberculosis subunit vaccine based on a fusion of antigen 85B and ESAT-6 in the aerosol guinea pig model[J]. Infect. Immunol. 72: 6148-6150
Skeiky et al. 2006. Nature Reviews Microbiology 4: 469-476
徐广贤. 2006. 牛分枝杆菌与肺结核分枝杆菌基因组的比较[J].现代生物医学进展. 6(7): 67-80
第一作者简介:贾浩,男,1984生,硕士研究生,主要从事微生物与基因工程方面的研究。
国家“973”计划项目子课题《病原生态学与分子流行病学研究》(NO:2006CB504401)、高等学校科技创新工程重大项目培育资金项目《牛结核病病原分子生物学及耐药机制研究》(NO:706057)、宁夏大学科研基金项目《牛肺泡巨噬细胞microRNA克隆与测序》(NO: ZR200724)资助。
通讯作者:王玉炯,宁夏大学生命科学学院院长,博士,教授,博士生导师。研究方向:微生物与基因工程。Tel:0951-2062033 ; E-mail:wyj@nxu.edu.cn
收稿日期:2008年7月14日;改回日期:2008年7月24日。
Draft strategic plan of the stop partnership working group on TB vaccine development.2nd gilbal plan to stop TB[J].GPII stat



 京公网安备11010102006642号
京公网安备11010102006642号